共计 1146 个字符,预计需要花费 3 分钟才能阅读完成。
正如人体每个器官各司其职,细胞内部的「细胞器」也是协同维持细胞的整体运作。这些膜包被的细胞器为大量核编码蛋白提供了最适理化环境,使其能够执行关键生物学功能。
为维持细胞组织与进程,细胞内部存在确保蛋白质准确送达的复杂机制 —— 蛋白质通过独特的氨基酸靶向序列被标记并运往特定细胞器。
线粒体作为为细胞提供能量的特殊细胞器,是基础研究、代谢工程和疾病治疗的主要靶向细胞器。但当前线粒体研究受限于现有线粒体靶向序列(MTS)的可用性。
近期,来自伊利诺伊大学厄巴纳 – 香槟分校(University of Illinois Urbana-Champaign,UIUC)的一项新研究展示了生成式人工智能在设计靶向序列方面的实用性。研究成果发表于《Nature Communications》。

论文地址:https://www.nature.com/articles/s41467-025-59499-3
解决 MTS 难题
天然 MTS 的长度从 10 到 120 个氨基酸不等,平均约 35 个氨基酸。目前仅发现并使用了少数 MTS,研究人员不得不重复使用相同序列,但实际上,不同载体蛋白需要不同的最优靶向序列。
MTS 的线粒体靶向能力源于其三维结构特征与化学特征,而非二维氨基酸序列。生成式 AI 能通过识别训练数据(天然 MTS)中人类难以察觉的复杂模式来解决这一问题。
研究团队采用「变分自编码器(VAE)」,识别出 MTS 三大关键特征:带正电荷、两亲性及易形成 α 螺旋结构。
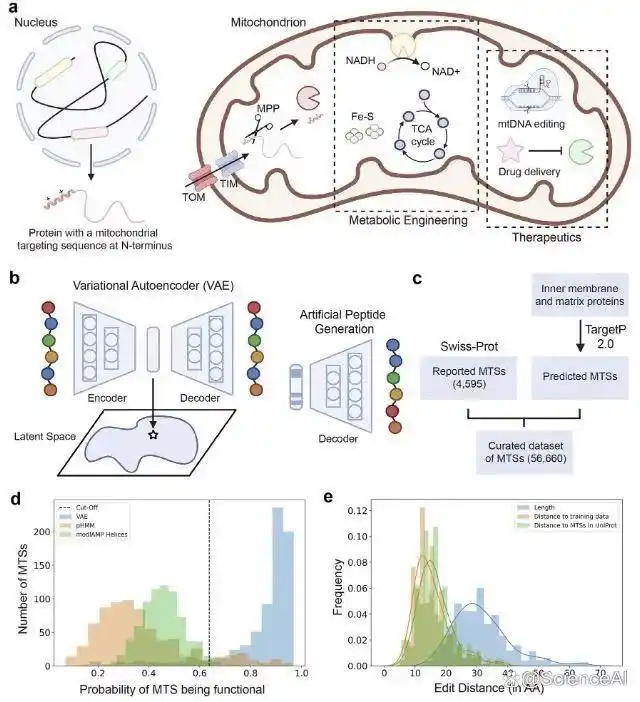
图示:用于生成线粒体靶向序列 (MTS) 的变分自编码器。
随后该研究设计采样方案优先筛选进行实验验证的 MTS,通过共聚焦显微镜在四种真核生物体内表征了 41 条自然界不存在的新肽段,获得 50-100% 的成功率。此外,该研究还在 HEK293 细胞系中证实这些肽段能在体内被成功剪切。
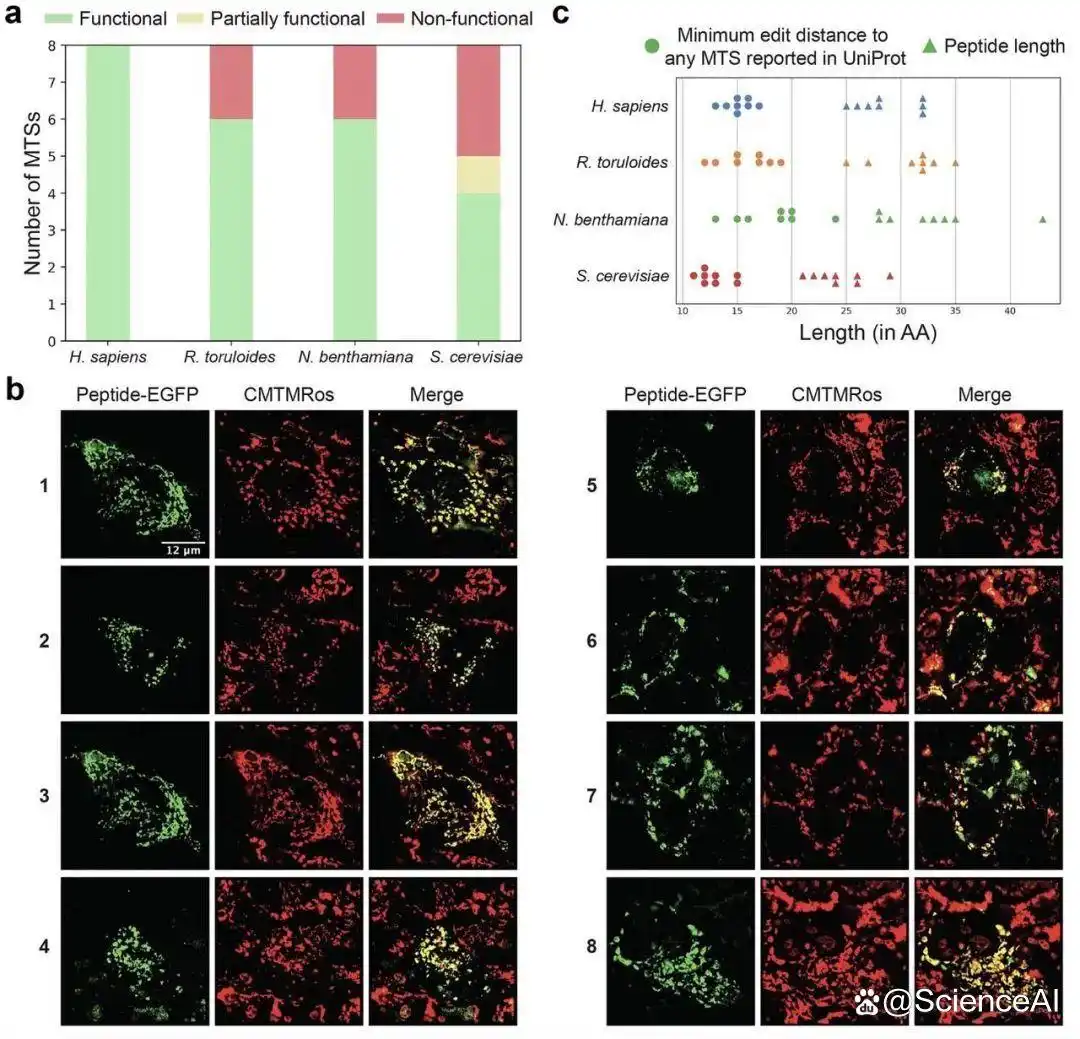
图示:四种真核生物中人工线粒体靶向序列(AMTS)的特征分析。
进一步分析显示,部分生成序列可能兼具靶向线粒体和叶绿体的能力。因此,该研究基于植物界 MTS 和叶绿体靶向序列(CTS)训练了 Dual-VAE 模型。
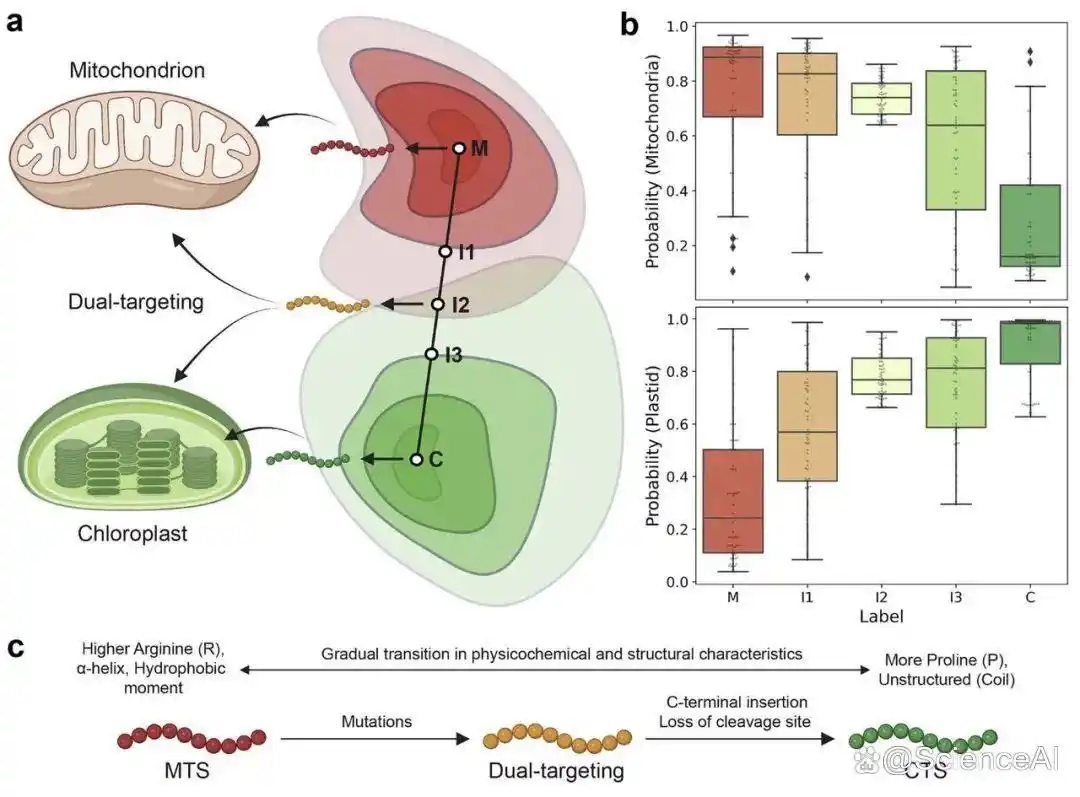
图示:利用 Dual-VAE 设计双靶向肽。
最后,该研究展示了特征肽在代谢工程与蛋白质递送中的应用,例如,采用嵌合 MTS 改进 HEM1 的线粒体靶向效率,可提升 4.76 倍。
总的来说,该研究采用的 VAE 模型能高效设计多样化功能性线粒体靶向序列及自然界未见的双靶向序列,显著提升了代谢工程与生物医学应用中必需物质的递送能力。
相关报道:https://phys.org/news/2025-05-harnessing-generative-ai-mitochondrial-toolkit.html
