共计 2751 个字符,预计需要花费 7 分钟才能阅读完成。
Sequence-to-function 模型是一类强大的基因组模型,能够直接从 DNA 序列预测对应的功能特征,如染色质开放性、基因表达量、DNA 剪切位点等。其中最具代表性的工作是 2021 年发表在《Nature Methods》的 Enformer 。
近日,谷歌 DeepMind 发布的 AlphaGenome 模型取得了重要突破。该模型将前身 Enformer 的输入序列长度扩展至 1Mb,引入了剪切强度、DNA 三维接触图等一系列新的训练任务,并实现了单碱基精度预测。
AlphaGenome 在众多基因组预测任务上达到了当前 SOTA 性能,再次证明了数据扩展在基因组学建模中的巨大潜力,同时也证明了 sequence-to-function model 这种有监督训练范式学习到的表征的巨大潜力。
然而,单纯的数据扩展并非提升模型能力的唯一路径。来自中国人民大学高瓴人工智能学院的研究团队提出了一个重要的替代思路:通过对模型架构进行符合生物学原理的系统性创新,可以更高效地提升 DNA 基础模型的性能与泛化能力。
相关论文以「SPACE: Your Genomic Profile Predictor is a Powerful DNA Foundation Model」为题,于 2025 年 6 月 2 日发布在了 arXiv 预印平台,目前已被 ICML2025 录用。
论文链接:https://arxiv.org/abs/2506.01833
Github链接: https://github.com/ZhuJiwei111/space
Huggingface链接: https://huggingface.co/yangyz1230/space
SPACE: Species-Profile Adaptive Collaborative Experts
Enformer 和 AlphaGenome 设计范式存在两个内在的架构性制约:
1. 物种共享编码器的局限性: 这种「一视同仁」的编码器难以有效区分并建模不同物种间基因调控的特有模式(species-specific characteristics)与进化上的保守机制 。
2. 独立预测头的知识割裂: 基因组的功能图谱,如染色质可及性、组蛋白修饰和转录因子结合,在生物学上是高度关联和协同作用的。独立的预测头无法捕捉这些图谱间的内在依赖关系,从而限制了模型对复杂基因调控网络的深层理解。

图 1:SPACE 模型架构总览。 模型包含三个核心阶段:(1) 基于 CNN 的局部上下文聚合模块;(2) 引入物种感知混合专家(MoE)的 Transformer 编码器;(3) 引入谱系分组和双层门控机制的增强型解码器。
为了应对上述挑战,我们设计的 SPACE 模型引入了两项关键的架构革新:
1. 物种感知编码器(Species-aware Encoder): 我们在 Transformer 编码器中部署了稀疏混合专家(MoE)层,以替代标准的前馈网络。该模块由一个共享的「专家」网络池和多个物种特异性的「门控网络」组成。对于来自特定物种的 DNA 序列,其对应的门控网络会动态地选择并加权激活一部分专家网络进行计算。这种设计使得模型能自适应地为不同物种分配不同的计算资源和参数路径,从而有效解耦并学习物种间的特有及共享调控特征。此外,我们还引入了专家-物种互信息损失函数,以鼓励专家网络向物种特异化的方向分化。
2. 谱系分组增强解码器(Profile-grouped Enhancement Decoder): 在解码阶段,我们依据生物学先验知识将功能相关的基因组图谱(如测量染色质可及性的 DNase-seq 和 ATAC-seq)进行分组。在此基础上,一个新颖的双层门控专家加权聚合模块被用于增强初始预测。第一层门控根据物种和序列的全局信息,动态选择最相关的「专家组」,以捕捉进化上的保守调控模式。第二层门控则在选定的专家组内部,根据各图谱的初步预测特征,为每个图谱精确选择并加权最合适的专家,从而建模图谱间的功能依赖性。最终,增强后的预测结果通过残差连接与初始预测融合,确保了训练的稳定性和预测的精确性。
我们在多个公认的基因组学基准上,对 SPACE 模型的性能进行了全面和严格的评估。
下游基因组任务基准测试
我们在 Nucleotide Transformer(NT)论文提出的一套包含 18 项下游分类任务的基准上,将 SPACE 与多个主流 DNA 基础模型进行了比较。这些任务涵盖了染色质谱系预测、调控元件注释和剪接位点识别三大类别。
实验结果表明,SPACE 模型在 18 项任务中的 11 项上取得了当前最佳(SOTA)性能,显著优于包括 DNABERT-2、HyenaDNA 以及 NT 系列在内的无监督预训练模型,也一致性地超越了其监督学习的基线模型 Enformer。这一结果强有力地支持了我们的核心论点:一个架构设计优良的监督式预测模型,其学到的序列表示(representation)具有强大的泛化能力,可以作为一个高效的 DNA 基础模型。

图 2:在 Nucleotide Transformer 下游任务中的性能比较(MCC 分数)。 表格展示了 SPACE 与多个基准模型在 18 项任务上的表现。加粗字体表示该任务上的最优性能。SPACE 在 11 项任务中达到 SOTA。
跨物种泛化能力评估
为了直接评估 SPACE 架构改进对模型跨物种泛化能力的影响,我们在 GUE 基准上进行了测试。我们特意选择了与模型训练物种(人、鼠)进化距离较远的酵母(10 项表观遗传标记预测任务)和病毒(COVID 变种分类任务)进行评估。
如下图所示,与同样使用人鼠数据进行预训练的 Enformer 相比,SPACE 在所有 11 项跨物种预测任务上均取得了显著的性能提升。尤其是在酵母的 H3K4me3 标记预测任务上,SPACE 的性能相较于 Enformer 提升了 27.28 个百分点,充分证明了我们提出的物种感知 MoE 编码器等架构在捕捉和迁移进化上保守的调控特征方面的有效性。
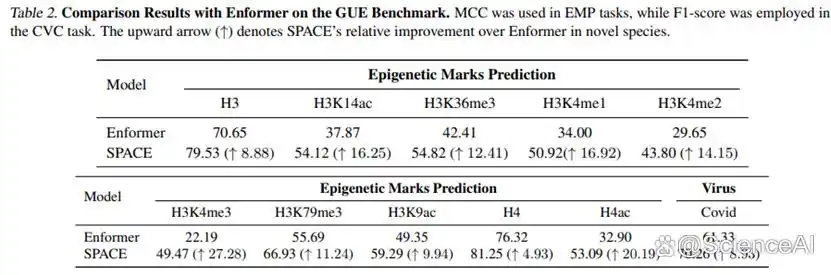
图 3:在 GUE 基准上与 Enformer 的跨物种泛化能力比较。 SPACE 在所有酵母和病毒预测任务上的性能(MCC 或 F1 分数)均显著高于 Enformer,向上箭头(↑)后的数值表示 SPACE 的绝对性能提升点数。
总结
AlphaGenome 展示了「数据规模为王」的强大潜力之际,我们的 SPACE 模型提供了另一条同样富有前景的技术路径:通过引入符合生物学原理的、动态自适应的先进架构,可以更深刻、更高效地捕捉 DNA 序列中的复杂调控语言。我们相信,这种将架构设计与生物学洞见深度融合的研究范式,将为未来构建更强大、更具解释性的基因组学AI模型铺平道路。我们已将所有代码和模型开源,以期与社区共同推动该领域的进步。
